Nutrizione
La scienza dell’autofagia nel dettaglio: oltre le popolari diete a digiuno
Il digiuno intermittente è stata la dieta più popolare del 2020. Che si tratti di 16:8, 5:2, o semplicemente di digiuno nei giorni feriali, 17 milioni di americani hanno seguito questo trend. Come avviene per tutte le diete alla moda, molte persone normali e celebrità hanno inondato Instagram con le loro storie di successo, e tutti ne sono diventati seguaci.
Ma vi siete mai domandati cosa succede nel corpo quando si digiuna a intermittenza?
Conoscete le evidenze scientifiche che stanno alla base dell’autofagia e del digiuno?
Oggi analizzeremo in dettaglio le conoscenze sull’autofagia e sul digiuno intermittente, in modo da avere una visione completa al 100% su ciò che accade nel nostro corpo.
Indice dei contenuti
Cos’è l’autofagia?
Il termine autofagia deriva dai vocaboli di origine greca “auto” e “fagia”. Mentre il primo significa se stessi, il secondo significa mangiare. Nell’unione dei due termini, autofagia significa letteralmente mangiare se stessi. E’ una forma di auto-cannibalismo, ma NON in senso cattivo. E’ semplicemente il modo naturale del corpo per ripulirsi dalle cellule morte, danneggiate e invecchiate. Così facendo, il corpo può produrre e rigenerare cellule nuove e sane.
Perché siamo sempre in modalità “pancia piena”
Nei circa 2 milioni di anni della nostra evoluzione, da quando gli uomini si sono differenziati dai grandi primati, ci sono stati periodi in cui il cibo era abbondante nel nostro ambiente. Ci sono state anche epoche in cui il cibo era scarso. Oggi tuttavia, almeno per la maggior parte degli abitanti delle nazioni sviluppate, c’è una costante abbondanza di calorie. Perciò, nella vita normale, non viviamo più il ciclo di carestia e di cibo in abbondanza come sarebbe accaduto una volta. Invece, siamo sempre bloccati sulla modalità “pancia piena”.
Il problema di ciò è che ci siamo evoluti per passare dalla scarsità all’abbondanza di cibo, perciò il nostro corpo funziona meglio quando è esposto ad entrambe le situazioni.
- Quando abbiamo abbastanza cibo, le cellule del corpo possono crescere e riprodursi. Ma quando non abbiamo cibo a sufficienza, il corpo può “attivare un interruttore metabolico”1, che si concentra sul rafforzare la risposta delle nostre cellule allo stress.
- Le cellule fanno questo demolendo i componenti cellulari vecchi e difettosi, rinnovando e rigenerandoli, e incrementando la produzione di elementi come gli antiossidanti.
- Le parti demolite possono quindi essere utilizzate per la produzione di nuovi componenti cellulari o di energia.
Idealmente, affinché un essere umano sia sano, ha bisogno di un giusto equilibrio tra le due fasi.
Pro e contro del digiuno a intermittenza
PRO: con troppo cibo, possono accumularsi proteine e altre parti cellulari danneggiate, il che fa sì che le cellule non facciano correttamente il loro lavoro. Poi, siccome le cellule costituiscono tutto il nostro corpo, organi compresi, alla fine tutto inizia ad andare storto.
CONTRO: Tuttavia, anche avere troppa fame può diventare un problema, perché spenderemmo troppo tempo a demolire le cellule in riparazione, senza fornire energia.
Dobbiamo realmente trovare un equilibrio tra queste due fasi. Il digiuno a intermittenza ci permette di fare ciò, perché così riusciamo ad imitare i periodi di carestia e mescolarli a periodi di abbondanza di cibo.
MTOR e autofagia
L’equilibrio tra digiuno e abbondanza di cibo ha un ruolo in due processi cellulari opposti che avvengono contemporaneamente nel nostro corpo; questi processi si chiamano mTOR e autofagia.
mTOR – Un enzima, l’Isola di Pasqua, e ciò che i culturisti sognano!
Il primo, la mTOR, è il processo di crescita. mTOR è l’abbreviazione per “mechanistic target of rapamycin”, che significa “bersaglio meccanicistico della rapamicina”.
Il nome è buffo, ma c’è un motivo. Esso deriva da un batterio del suolo che è stato scoperto per la prima volta durante una spedizione sull’Isola di Pasqua negli anni ‘60 del secolo scorso. L’Isola di Pasqua è un isola del Pacifico che si trova a circa 3000 chilometri dalla costa del Cile, ed è famosa per il sito patrimonio dell’umanità che comprende più di mille statue antiche. L’Isola di Pasqua è inoltre conosciuta dagli abitanti dell’isola come Rapa Nui,e il batterio è stato chiamato rapamicina pensando agli abitanti dell’isola di Rapa Nui.
Effettivamente, la mTOR non è un batterio del suolo. In realtà si tratta di un enzima prodotto nel corpo. Ma il batterio del suolo conosciuto come rapamicina stimola l’attività della mTOR, perciò l’enzima è diventato noto come il “target” o obiettivo della rapamicina. Quando questo enzima viene stimolato, le cellule iniziano a crescere, a produrre proteine e a riprodursi più velocemente. La mTOR è ben nota ai culturisti e agli atleti che praticano sport che richiedono particolari sforzi, e che cercano di stimolarla il più possibile.
L’autofagia – Il dato scientifico alla base delle diete che usano il digiuno
Il processo opposto alla mTOR viene chiamato autofagia, e avviene quando le cellule iniziano a demolire le parti vecchie e danneggiate. Dal momento che i due processi sono uno l’opposto dell’altro, quando la mTOR viene stimolata, l’autofagia è di conseguenza bassa. E quando l’autofagia viene stimolata, la mTOR è bassa.
Come funziona esattamente l’autofagia?
• Nell’autofagia, le cellule formano speciali strutture chiamate fagofori.
• I fagofori sono membrane che crescono lentamente per creare una specie di sfera ricoperta da una membrana.
• La membrana è costituita da una sostanza chiamata doppio strato lipidico.
• I lipidi sono molecole a base grassa, e i doppi strati lipidici circondano gli organelli cellulari e tutti i 20 miliardi di cellule che abbiamo nel corpo!
• Gli organelli svolgono diverse funzioni nelle nostre cellule e possono essere visti un po’ come i diversi organi che abbiamo nel corpo.

Formazione dei fagofori
Mentre la sfera, o il fagoforo si sta formando completamente, si muove attorno alla cellula, per raccogliere le proteine e gli altri organelli a cui è stato attribuito un marker speciale che riferisce al fagoforo che questi elementi sono stati selezionati per essere demoliti. Questo speciale marker viene chiamato ubiquitina. Il fagoforo quindi si muove attorno alla cellula raccogliendo tutte le proteine e gli organelli ubiquitinati.
Completamento della formazione dei fagofori
Successivamente si formano le membrane complete attorno alle proteine e agli organelli. Quando ciò avviene, il nome della struttura cambia da fagoforo a autofagosoma. L’autofagosoma si sposta quindi verso un lisosoma e si fonde con esso. Il lisosoma è un organello che può essere immaginato come lo stomaco della cellula, anche se ciò non è completamente vero, perché ogni cellula contiene più lisosomi.
Tuttavia, proprio come nel nostro stomaco, il contenuto dei lisosomi è acido e contiene degli enzimi digestivi che demoliscono le proteine e gli organelli. Una volta demoliti in aminoacidi semplici, essi possono essere utilizzati per produrre nuove proteine, organelli e persino nuove cellule. Oppure possono anche essere usati per produrre energia dal fegato in un processo conosciuto come gluconeogenesi. Gli aminoacidi utilizzati per le nuove cellule e proteine riescono in questo compito grazie allo stimolo che ricevono dall’enzima mTOR, perciò il ciclo si completa da solo mentre il corpo passa tra autofagia e mTOR.
C’è anche un tipo specifico di autofagia che ha a che fare con i mitocondri. Questo avviene attraverso una degradazione selettiva dei mitocondri, in un processo chiamato mitofagia. I mitocondri, anch’essi organelli, sono i motori delle nostre cellule e sono deputati alla produzione di energia. Ne abbiamo una grande quantità nelle nostre cellule, anche oltre duemila.
Tuttavia, dal momento che utilizziamo l’ossigeno per la produzione di energia, e l’ossigeno genera stress ossidativo, i nostri mitocondri devono costantemente vedersela con i radicali liberi. Ciò significa che i mitocondri sono molto sensibili ai danni, perciò la demolizione e la riparazione di mitocondri è un processo di importanza fondamentale che viene intrapreso con la mitofagia.

In che modo il digiuno stimola l’autofagia e la mitofagia
Quando digiuniamo, c’è una riduzione dell’energia che arriva al corpo attraverso il cibo. Ciò porta ad un leggero squilibrio energetico, dal momento che viene utilizzata più energia di quella che viene prodotta. Uno speciale enzima nel nostro corpo tiene costantemente sotto controllo questo equilibrio energetico: questo enzima si chiama AMPK (adenosine monophosphate-activated protein kinase).
L’AMPK riesce a fare ciò rilevando ciò che viene conosciuto come rapporto tra AMP e ATP.
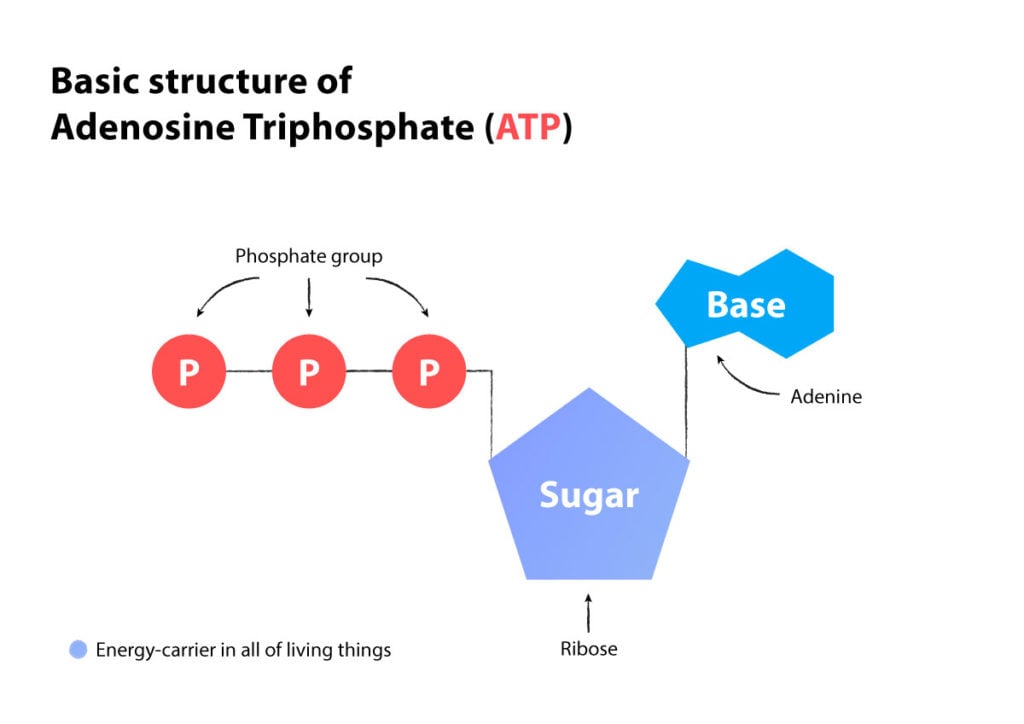
L’ATP produce energia mentre rilascia una molecola di fosfato e viene trasformata in ADP. Quando l’energia è bassa, vengono unite insieme due unità di ADP per ottenere un’ATP, e così resta libera un’AMP. (L’ATP è una molecola di adenosina alla quale sono legati tre fosfati, l’ADP è una molecola di adenosina alla quale sono legati due fosfati, e l’AMP è una molecola di adenosina alla quale è legato un fosfato).
ATP = Adenosina trifosfato (3 fosfati)
ADP = Adenosina difosfato (2 fosfati)
AMP = Adenosina monofosfato (1 fosfato)
Quando due ADP si uniscono (due fosfati più due fosfati), viene prodotta l’ATP (tre fosfati) e quindi avanza un’AMP (un fosfato di resto).
Se il rapporto tra AMP e ATP, aumenta, significa che c’è meno energia disponibile, e perciò viene stimolata l’AMPK. Quando l’AMPK viene stimolata, a sua volta essa stimola un’altra proteina chiamata ULK1, che determina la produzione delle membrane che poi diventano i fagofori.
La NAD+ e le sirtuine
Il digiuno aumenta anche i livelli di NAD+, la forma ossidata di NADH, che è una forma attiva di Vitamina B3 (necessaria per la produzione di energia.
Le sirtuine sono una famiglia di proteine che stimolano direttamente l’autofagia
La produzione di energia nei mitocondri determina la trasformazione di più NADH in NAD+. Questo aumento nel rapporto tra NAD+ e NADH stimola la produzione delle sirtuine.
Le sirtuine sono una famiglia di proteine che stimola direttamente l’autofagia. La loro produzione è inoltre associata con un allungamento della durata di vita e ad un incremento della riparazione del DNA2.
Inoltre, sia l’AMPK che le sirtuine attivano altri geni che sono conosciuti per le loro proprietà benefiche per la salute, in particolare i geni FoxO, TFEB, PGC-1a e P53.
- L’attivazione dei geni della famiglia FoxO è associata con un aumento della resistenza allo stress, ad una maggiore aspettativa di vita e ad una minore incidenza dei tumori (ad esempio il cancro). Ciò è dovuto alle cellule disfunzionali, le quali commettono ciò che viene definito “suicidio cellulare” (apoptosi) invece che continuare a crescere e diventare potenziali tumori3.
- Il TFEB è lo stimolatore principale per la produzione di nuovi lisosomi, perciò è direttamente coinvolto nell’autofagia.
- Il P53 è conosciuto come il “guardiano del genoma”, perché previene le mutazioni del DNA4 e inibisce la formazione dei tumori5.
- Il PGC-1a è il gene principale coinvolto nella stimolazione della produzione di nuovi mitocondri. Più mitocondri abbiamo, meno stress subiscono i mitocondri esistenti per la produzione dell’energia di cui abbiamo bisogno. Ciò rende più efficiente la nostra produzione di energia, e più efficiente è questo processo, meno radicali liberi avremo.
Il ruolo della chetosi nell’autofagia
Il digiuno a intermittenza porta inoltre a bruciare tessuti grassi, con l’aumento dei livelli di acidi grassi liberi in arrivo al fegato. Ciò incrementa il quantitativo di chetoni prodotti6.
I chetoni sono molecole a base grassa in grado di produrre energia.
I chetoni sono molecole a base grassa in grado di produrre energia in modo molto efficiente. Bruciare chetoni per ottenere energia fa sì che vengano prodotti meno radicali liberi, e il loro utilizzo riduce le infiammazioni. Inoltre, i chetoni stimolano la produzione del BDNF (brain-derived neurotrophic factor, o fattore neutrofico cerebrale). Il BDNF è un ormone della crescita del cervello e stimola la crescita di nuove cellule cerebrali (neuroni). Esso è inoltre in grado di favorire la generazione di nuove sinapsi, che sono le connessioni tra i neuroni7. Più connessioni (o sinapsi) abbiamo, più siamo in grado di imparare e capire.
Perché le diete che prevedono il digiuno sono così popolari nel 2021?
A questo punto viene da domandarsi: in che modo questa scienza del digiuno su Internet si traduce effettivamente in benefici per la salute?
Perdita di peso
Molti decidono di provare il digiuno per i suoi benefici legati alla perdita di peso. Esistono studi che hanno dimostrato che, in media, i soggetti hanno perso tra il 2,5% e il 9,9% del loro peso corporeo nel periodo di 3-6 mesi durante il quale questi studi sul digiuno si sono protratti8 9. E’ stato notato che questa perdita di peso è derivata dalla perdita di massa grassa e non dalla perdita di massa muscolare.
Il digiuno può aiutare a regolare i livelli di glucosio e insulina
E’ stato anche dimostrato che il digiuno a intermittenza può ridurre i livelli di glucosio e insulina a digiuno nei pazienti diabetici10, nei soggetti obesi11, e in individui non obesi12. Inoltre, uno studio su giovani donne in sovrappeso ha scoperto un calo dei livelli di colesterolo totale e LDL, dei trigliceridi e della pressione sanguigna. Tali studi hanno anche evidenziato una riduzione del marker infiammatorio conosciuto come proteina C-reattiva e dell’ormone della leptina, che di norma aumenta di livello con l’obesità.
Il digiuno aiuta a regolare il testosterone
Tali studi hanno anche scoperto un incremento dell’SHBG (sex hormone-binding globulin, o globuline leganti gli ormoni sessuali), che aiuta a ridurre gli effetti del testosterone. Tuttavia, quando i livelli di testosterone aumentano troppo nelle donne, può avere effetti collaterali indesiderati13.
Il digiuno a intermittenza può persino avere effetti anti-invecchiamento
La maggior parte degli studi che si trovano su internet relativi al digiuno e all’invecchiamento sono condotti su animali. Il motivo è semplice: è molto difficile condurre questi studi su esseri umani, poiché non è possibile seguire le persone per tutta la vita, o perlomeno non è possibile farlo assicurandosi che continuino a seguire un protocollo di digiuno a intermittenza.
Tuttavia, la stimolazione dell’AMPK e delle sirtuine durante il digiuno a intermittenza sono fortemente associati con un allungamento dell’aspettativa di vita negli animali.
Gli studi hanno scoperto che il digiuno a intermittenza aumenta l’aspettativa di vita nei topi e nelle scimmie, e li rende meno soggetti a sviluppare malattie legate all’invecchiamento14. Uno studio sui topi ha inoltre evidenziato che i topi che avevano digiunato avevano evitato il calo della massa muscolare che avviene durante il normale processo di invecchiamento15.
In conclusione: vale davvero la pena stimolare l’autofagia con il digiuno a intermittenza?
Il digiuno a intermittenza può avere alcuni benefici davvero positivi per la salute:
- Può stimolare l’autofagia.
- E’ associato ad un incremento dell’aspettativa di vita.
- Può stimolare la produzione di nuovi mitocondri.
- Riduce le infiammazioni e migliora la salute cardiovascolare.
- Può aiutare a perdere peso.
- Può aiutare ad abbassare i livelli elevati di testosterone nelle donne.
Tuttavia, anche se ci sono eccellenti benefici, non ho parlato di un potenziale problema legato al digiuno. Vale a dire, dobbiamo assicurarci di essere a digiuno, ma non di patire la fame.
Quando il digiuno viene praticato correttamente, non dovrebbero prodursi effetti collaterali spiacevoli come vertigini, stanchezza, irritabilità, o altre situazioni particolarmente negative.
Sentirsi leggermente affamati va bene. Tuttavia, quando ci si sente male o non si riesce a resistere prima di arrivare al pasto, significa che il nostro corpo sta rispondendo alla fame.
La risposta alla fame avviene quando non produciamo abbastanza chetoni per rifornire il cervello. Dal momento che il cervello non riceve abbastanza energia derivante dal cibo, esso percepisce una pericolosa carenza di cibo, e perciò fa in modo di indurci a fare il minor quantitativo di sforzi possibile e a risparmiare energia, facendoci sentire male e a disagio.
Ho scritto una guida dettagliata su come evitare la risposta alla fame, perciò ti consiglio di leggerla per capire se il digiuno a intermittenza può fare al caso tuo.
Con le giuste informazioni e una corretta comprensione di come funziona il digiuno a intermittenza, molti possono provare questa dieta e godere di tutti i potenziali benefici per la salute!
Riferimenti
- Stephen D. Anton, Keelin Moehl, William T. Donahoo, Krisztina Marosi, Stephanie Lee, Arch. G. Mainous III, Christiaan Leeuwenburgh, e Mark P. Mattson, Flipping the Metabolic Switch: Understanding and Applying Health Benefits of Fasting, Obesity (Silver Spring). Febbraio 2018; 26(2): 254–268. ↩︎
- Uribarri J, Woodruff S, Goodman S, Cai W, Chen X, Pyzik R, et al., Advanced glycation end products in foods and a practical guide to their reduction in the diet. J. Am. Diet. Assoc. 2010;110: 911–916 ↩︎
- Eric L. Greer & Anne Brunet, FOXO transcription factors at the interface between longevity and tumor suppression, Oncogene volume 24, pages 7410–7425 (2005) ↩︎
- Read A.P., Strachan T. (1999). “Chapter 18: Cancer Genetics”. Human molecular genetics 2. New York: Wiley. ↩︎
- Surget S., Khoury M.P., Bourdon J.C., “Uncovering the role of p53 splice variants in human malignancy: a clinical perspective”. OncoTargets and Therapy. 7: 57–68. Dicembre 2013. ↩︎
- Stephen D. Anton, Keelin Moehl, William T. Donahoo, Krisztina Marosi, Stephanie Lee, Arch. G. Mainous III, Christiaan Leeuwenburgh, e Mark P. Mattson, Flipping the Metabolic Switch: Understanding and Applying Health Benefits of Fasting, Obesity (Silver Spring). Febbraio 2018; 26(2): 254–268. ↩︎
- Stephen D. Anton, Keelin Moehl, William T. Donahoo, Krisztina Marosi, Stephanie Lee, Arch. G. Mainous III, Christiaan Leeuwenburgh, e Mark P. Mattson, Flipping the Metabolic Switch: Understanding and Applying Health Benefits of Fasting, Obesity (Silver Spring). Febbraio 2018; 26(2): 254–268. ↩︎
- Heilbronn L.K., Smith S.R., Martin C.K., Anton S.D., Ravussin E., Alternate-day fasting in nonobese subjects: effects on body weight, body composition, and energy metabolism. Am. J. Clin. Nutr. [Internet] 2005; 81:69–73. ↩︎
- Byrne N.M.M., Sainsbury A., King N.A.A., Hills A.P.P., Wood R.E.E.. Intermittent energy restriction improves weight loss efficiency in obese men: the MATADOR study. Int. J. Obes. [Internet] 2017; 1–10. ↩︎
- M’guil M., Ragala M.A., El Guessabi L., Fellat S., Chraibi A., Chabraoui L., et al., Is Ramadan fasting safe in type 2 diabetic patients in view of the lack of significant effect of fasting on clinical and biochemical parameters, blood pressure, and glycemic control? Clin. Exp. Hypertens. 2008;30:339–57. ↩︎
- Heilbronn L.K., Smith S.R., Martin C.K., Anton S.D., Ravussin E., Alternate-day fasting in nonobese subjects: effects on body weight, body composition, and energy metabolism. Am. J. Clin. Nutr. [Internet] 2005; 81:69–73. ↩︎
- M’guil M., Ragala M.A., El Guessabi L., Fellat S., Chraibi A., Chabraoui L., et al., Is Ramadan fasting safe in type 2 diabetic patients in view of the lack of significant effect of fasting on clinical and biochemical parameters, blood pressure, and glycemic control? Clin. Exp. Hypertens. 2008;30:339–57. ↩︎
- Harvie M.N., Pegington M., Mattson M.P., Frystyk J., Dillon B., Evans G., et al., The effects of intermittent or continuous energy restriction on weight loss and metabolic disease risk markers: A randomized trial in young overweight women. Int. J. Obes. 2011;35:714–27. ↩︎
- Mattson M.P., Wan R.J., Beneficial effects of intermittent fasting and caloric restriction on the cardiovascular and cerebrovascular systems. Nutr. Biochem. Marzo 2005 16(3):129-37. ↩︎
- Van Norren K., Rusli F., Van Dijk M., Lute C., Nagel J., Dijk F.J., Dwarkasing J., Boekschoten M.V., Luiking Y., Witkamp R.F., Müller M., Steegenga W.T., Behavioural changes are a major contributing factor in the reduction of sarcopenia in caloric-restricted ageing mice. J. Cachexia Sarcopenia Muscle. Settembre 2015; 6(3):253-68. ↩︎

